请从下载中心下载附件
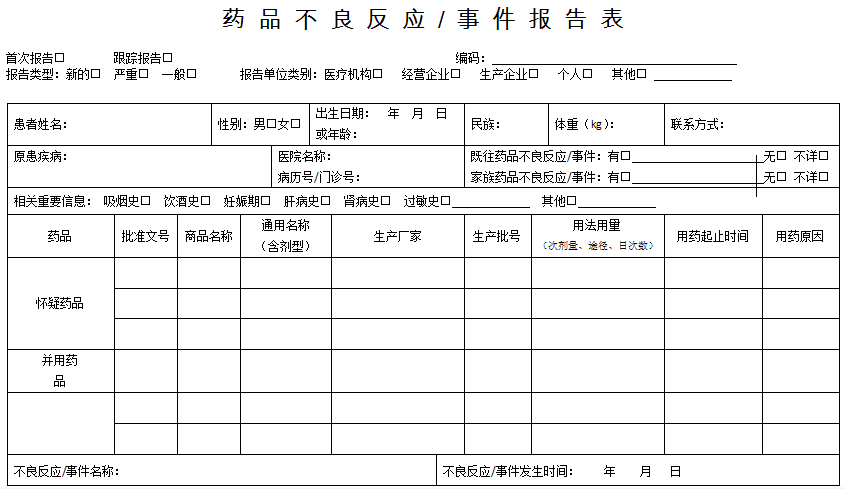
《药品不良反应/事件报告表》填写说明
1.《药品不良反应/事件报告表》应填写真实事件,报表所列患者信息及怀疑药品信息项目必须真实、完整、准确。
2.《药品不良反应/事件报告表》填写字迹要清晰,其中选择项画“√”,叙述项应准确、简明,不得有缺漏项。
3. 新的□ 严重□ 一般□
(1)新的药品不良反应:是指药品说明书中未载明的不良反应。说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
根据不良反应/事件损害的严重程度,不良反应/事件可能是新的严重的,也可能是新的一般的。
(2)严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
(3)一般:指新的、严重的药品不良反应以外的所有不良反应。
4. 单位名称:必须填写单位的完整全称,如日照市人民医院。
5. 部门:应填写科室的标准全称,如:消化内科、普外三科等。
6. 电话:填写报告部门(即科室)的电话。
7. 报告日期:指上交不良反应/事件报告的时间。新的或严重的药品不良反应/事件应于发现之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应应30日内报告。有随访信息的,应当及时报告。
8. 患者姓名:填写患者真实全名。
9. 体重:以千克为单位。如果不知道准确体重,请做一个最佳的估计。
10. 联系方式:最好填写患者的联系电话,也可填写患者的通信地址。
11. 家族药品不良反应/事件及既往药品不良反应/事件情况:请选择正确选项。如果选择“有”,则在报告的空白处清晰叙述。
12. 不良反应/事件名称:应填写不良反应中最主要、最明显的症状。
13. 不良反应/事件发生时间:应填写发生不良反应/事件的确切时间。
14. 病历(门诊)号:请如实填写,便于查找病例,具体分析不良反应/事件。
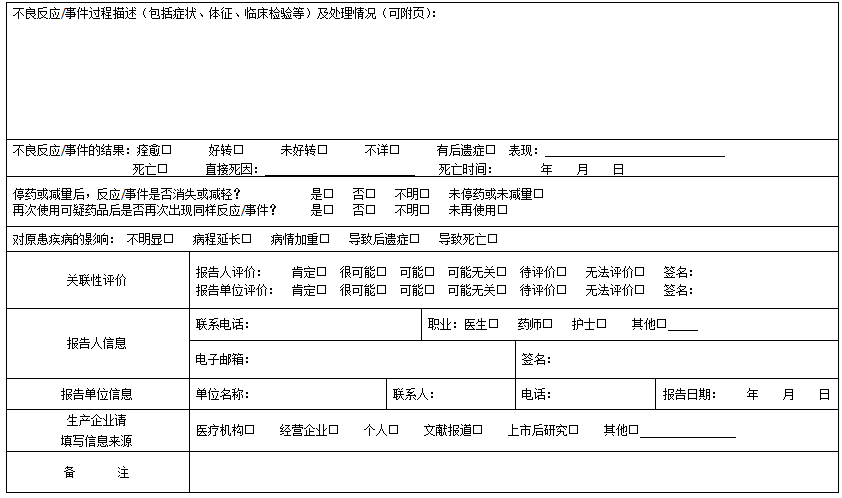
15. 不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
不良反应过程描述应具体、规范,须体现出“3个时间、3个项目和2个尽可能”。
*3个时间:①不良反应发生的时间;②采取措施干预不良反应的时间;③不良反应终结的时间;
*3个项目:①第一次药品不良反应出现时的相关症状、体征和相关检查;②药品不良反应动态变化的相关症状、体征和相关检查; ③发生药品不良反应后采取的干预措施结果;
*2个尽可能:①不良反应/事件的表现填写时要尽可能明确、具体。如为过敏型皮疹,要填写皮疹的类型、性质、部位、面积大小等;如为上消化道出血,有呕血者需估计呕血量的多少等;严重病例应注意生命体征指标(体温、血压、脉搏、呼吸)的记录。②与可疑不良反应/事件有关的辅助检查及临床检验(血常规、肝功能、肾功能、血脂分析、血气、心脏功能等)结果要尽可能明确填写。如怀疑某药引起血小板减少症,应填写病人用药前的血小板记数情况及用药后的变化情况。如怀疑某药引起的药物性肝损害,应填写用药前后的肝功变化。所有检查要注明检查日期。
一般格式为:患者因×××疾病于×××月×××日(必要时应详细到×××时分)以×××途径给予×××药品,×××剂量,用药×××时间出现×××反应(反应描述须明确、具体),×××时间后给予是否停药及×××处理(包括以×××途径给予×××药品及×××剂量,和其他处理措施),处理后×××时间患者转归情况。
16. 商品名称:如果确定该药品无商品名,填写无。
17. 通用名称:填写完整的药品通用名称,不可使用简称。
18. 生产厂家:填写药品说明书上的药品生产企业的全称,如“山东鲁抗医药股份有限公司”。
19. 药品批号及药品批准文号:区别药品批号和批准文号的概念。药品批号:在规定限度内具有同一性质和质量,并在同一连续生产周期中生产出来的一定数量的药品。药品批号是指用于识别“批”的一组数字或者字母加数字。用以追溯和审查该批药品的生产历史(如0912001或2009120001)。药品批号一般和药品的有效期、生产日期在同一位置。药品批准文号是药品生产合法性的标志,生产药品必须经过国务院药品管理部门批准,并发给药品批准文号(如国药准字H44021518、国药准字Z10890019)等。2012年新版ADR报表需要正确填写药品批号及药品批准文号。
20. 用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
21. 用药起止时间:指使用药品的同一剂量的开始时间和停止时间。
22. 用药原因:填写使用该药品的原因,应详细填写。例如:患者高血压病史,此次因肺部感染而注射氨苄青霉素引起不良反应,用药原因栏应填写肺部感染。
23. 怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
24. 不良反应/事件结果:本次不良反应/事件经采取相应的医疗措施后的结果,不是指原患疾病的结果。患者因不良反应/事件导致死亡时,应指出直接死因和死亡时间。对于不良反应/事件结果为有后遗症或死亡的病例,应附补充报告(病历资料)。
25. 原患疾病:即病例中的诊断,疾病诊断应写标准全称。
26. 对原患疾病的影响:对原患疾病的影响是指药品不良反应对原患疾病的影响。
27. 国内、外有无类似的不良反应:国内外若有类似的不良反应报道,请简述。
28. 关联性评价:只需填写报告人评价并签名。
29. 不良反应分析:请根据自己的判断在相应方框内打对√。
30. 报告人职业和报告人签名:请按要求填写。



 川公网安备 51019002000467号
川公网安备 51019002000467号